研究内容
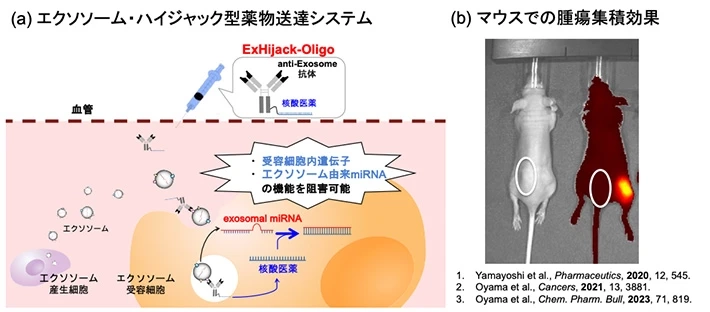
体液循環型細胞外小胞を介在した新しい薬物送達システムの構築
細胞は『エクソソーム』と呼ばれる小胞を放出し、他の細胞に情報を伝達しています。近年、がん細胞が分泌するエクソソームに、がんの転移や増殖に重要な役割を果たす様々な分子が搭載されていることが明らかになりました。とりわけエクソソームに含まれる小さな遺伝子(microRNA:exosomal-miRNA)は、新たな治療標的として注目されています。我々はエクソソームに随伴して取り込まれ、exosomal-miRNAの機能を阻害する新しい抗体結合型核酸の開発に成功しました。現在、この技術を基盤とした「エクソソーム・ハイジャック型薬物送達システム」の社会実装を目指して研究を進めています。
日経バイオテク:https://bio.nikkeibp.co.jp/atcl/news/p1/17/08/26/03130/
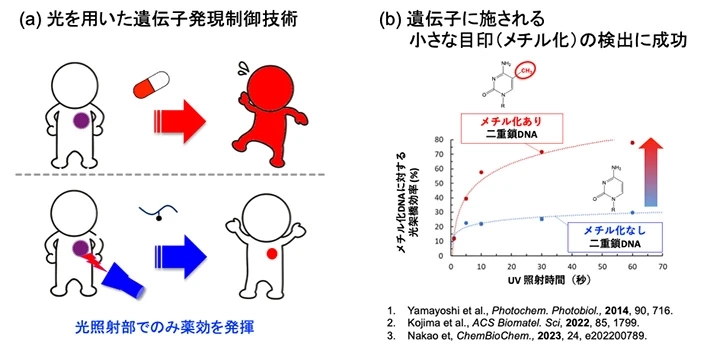
光を用いた遺伝子発現制御技術の開発
核酸医薬は標的遺伝子に対して配列特異的に結合する性質から、副作用の少ない高度医薬品として注目を集めていますが、我々は光を用いて核酸医薬の薬効を制御する新しい人工核酸の開発に取り組んでいます。この人工核酸を用いることで、細胞内非コードRNAの機能制御や、遺伝子に施される小さな目印(メチル化)を特異的に検出することに成功しております。またさらに、この技術を応用することで、遺伝情報を書き換える「ゲノム編集」へと展開しようと研究を進めています。
医薬経済ONLINE:https://iyakukeizai.com/iyakukeizaiweb/detail/177661
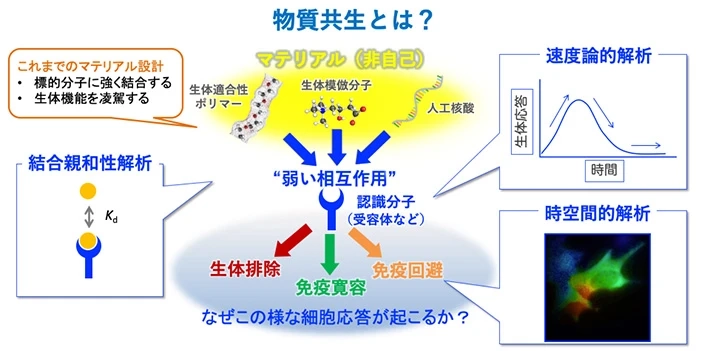
物質共生を可能とする人工核酸の開発
高度に最適化された抗体医薬や核酸医薬をはじめ、多くのバイオ医薬品において免疫原性が認められ、これを回避するのは現状ではほぼ不可能と言えます。我々は、これらの機能性分子、特に人工核酸が「なぜ免疫原性を示すのか?」について、分子レベルで解明することにより、生体との共生(物質共生)を可能とする可能な新しい核酸医薬の創製を目指しています。
文部科学省科学研究費補助金 学術変革領域(A)「マテリアル・シンバイオシスのための生命物理化学」(領域略称:物質共生):https://material-symbiosis.jp




